Entendendo a demência na doença de Alzheimer: sintomas, diagnóstico e tratamento
Entender sobre a demência na doença de Alzheimer é fundamental para lidar com esta doença neurodegenerativa complexa que afeta milhões de pessoas globalmente.
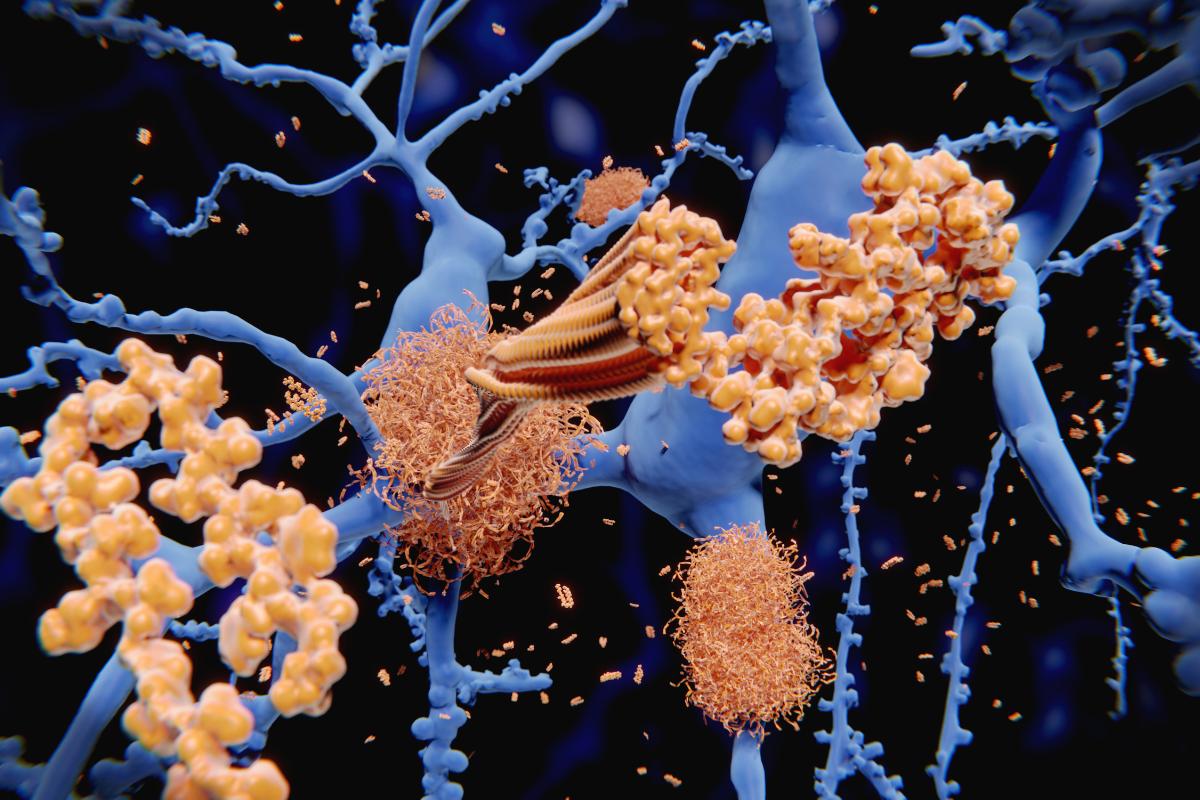
Esta condição leva a deterioração progressiva das funções cognitivas, como memória e linguagem, devido ao acúmulo de placas de proteína beta-amilóide e formação de emaranhados neurofibrilares de proteína tau no cérebro.
Diagnosticar precocemente é importante para iniciar tratamentos que podem melhorar a qualidade de vida dos pacientes.
A pesquisa atual concentra-se em novos medicamentos, avanços em tecnologias de imagem e estratégias de cuidado não farmacológicas.
Compreender esses aspectos não apenas ajuda no manejo da doença, mas também oferece esperança através de terapias mais eficazes e personalizadas.
História da demência de Alzheimer
A história da demência de Alzheimer remonta ao início do século XX, quando o médico alemão Alois Alzheimer descreveu pela primeira vez a condição em uma paciente de 51 anos. Ele observou um quadro demencial clinicamente caracterizado por mudanças progressivas profundas no comportamento e na memória da paciente, que faleceu em 1906. Ao examinar seu cérebro post-mortem, o Dr. Alzheimer identificou um cérebro com uma doença com características distintas, como placas e emaranhados anormais.
Desde então, pesquisadores têm continuado a investigar e compreender melhor a doença. Nos anos subsequentes, estudos adicionais expandiram o conhecimento sobre os mecanismos neuropatológicos que levam à demência de Alzheimer, incluindo o papel das proteínas beta-amilóide e tau na degeneração neuronal.
A descoberta de genes associados à demência na doença de Alzheimer nas décadas de 1990 e 2000 trouxe novas informações sobre os fatores genéticos predisponentes à doença. Esses avanços permitiram o desenvolvimento de testes genéticos e abriram caminho para estudos mais direcionados sobre prevenção e tratamento.
Atualmente, a história do conhecimento sobre a demência na doença de Alzheimer continua a evoluir com avanços significativos em neuroimagem, biomarcadores e terapias experimentais.
A compreensão cada vez maior da complexidade da doença impulsiona a busca por intervenções mais eficazes e estratégias preventivas para enfrentar este desafio crescente de saúde pública global.
O que é a demência na doença de Alzheimer e sua importância médica?
A demência na doença de Alzheimer - comumente chamada de demência de Alzheimer - é uma doença neurodegenerativa que afeta principalmente idosos, caracterizada por perda da capacidade funcional devido ao declínio progressivo nas funções cognitivas, como memória e linguagem.
A doença de Alzheimer, por sua vez, é o conjunto de alterações biológicas no tecido cerebral caracterizado pelo acúmulo anormal de placas de proteína beta-amilóide e pela formação de emaranhados neurofibrilares no cérebro, resultando na perda gradual de células nervosas que leva progressivamente ao quadro demencial.
A importância médica da demência de Alzheimer é extremamente significativa devido à sua crescente prevalência global, representando um desafio substancial para pacientes, cuidadores e sistemas de saúde.
Diagnosticar a doença precocemente é crucial para iniciar intervenções terapêuticas e de suporte adequadas, que não apenas ajudam a retardar a progressão da doença, mas também melhoram significativamente a qualidade de vida dos afetados.
Atualmente, a pesquisa está intensamente focada no desenvolvimento de tratamentos mais eficazes e estratégias preventivas para enfrentar esse problema de saúde pública crescente.
Compreender continuamente os mecanismos subjacentes à demência de Alzheimer é essencial para avançar no diagnóstico precoce e no manejo da doença, oferecendo esperança para o futuro na luta contra essa condição incapacitante.
Investimentos significativos em pesquisa estão sendo feitos para identificar biomarcadores precoces, explorar novas terapias farmacológicas e não farmacológicas, e investigar fatores genéticos e ambientais que podem influenciar o desenvolvimento da doença.
Esses esforços são essenciais para encontrar soluções eficazes que possam fazer uma diferença tangível na vida dos pacientes e suas famílias.
Sobre a demência de Alzheimer
A demência de Alzheimer é uma condição cerebral progressiva e irreversível que afeta mais de 6,5 milhões de americanos com 65 anos ou mais. Essa condição gradualmente compromete a memória, as habilidades de pensamento e, progressivamente, a capacidade de realizar tarefas simples, tornando-se a forma mais comum de demência entre os idosos e uma preocupação significativa de saúde pública.
Embora as causas específicas da doença de Alzheimer não sejam totalmente conhecidas, atualmente a ciência considera que a doença deve-se essencialmente ao acúmulo de placas beta-amilóides e, consequentemente, à formação de emaranhados neurofibrilares de proteína tau no cérebro.
Essas alterações resultam na perda de neurônios e suas conexões, impactando severamente a capacidade de lembrar, pensar e se comunicar. À medida que avança, os sintomas se intensificam, levando à necessidade de assistência completa.
Inicialmente, a doença de Alzheimer se manifesta com perda de memória recente, dificuldade em encontrar palavras e desorientação temporal. Com a progressão, surgem desorganização mental, alterações de humor e comportamento, além de dificuldades com linguagem e coordenação. Eventualmente, os pacientes perdem a capacidade de realizar atividades cotidianas e reconhecer entes queridos.
Além do impacto devastador para os pacientes, a demência de Alzheimer impõe um ônus significativo aos cuidadores e sistemas de saúde, elevando os custos e demandando cuidados especializados à medida que a doença avança. Investigações contínuas são cruciais para melhorar o entendimento da doença e desenvolver tratamentos mais eficazes e estratégias preventivas.
A educação e conscientização sobre a doença de Alzheimer são essenciais para diagnóstico precoce e manejo adequado, promovendo melhor qualidade de vida para todos afetados.
Epidemiologia da demência de Alzheimer
A epidemiologia da demência de Alzheimer revela-se uma preocupação crescente à medida que a população global envelhece. Estima-se que mais de 50 milhões de pessoas em todo o mundo vivam com demência de Alzheimer ou outra forma de demência, e esse número deve quase triplicar até 2050. A prevalência de demência varia significativamente por região e está intimamente ligada ao aumento da expectativa de vida.
Nos Estados Unidos, por exemplo, cerca de 6 milhões de pessoas têm demência de Alzheimer, e esse número continua a aumentar. Na Europa, a doença afeta aproximadamente 10 milhões de indivíduos, enquanto na Ásia a prevalência também está em ascensão devido ao envelhecimento populacional e mudanças no estilo de vida.
A incidência de demência de Alzheimer é maior em idosos, com a idade sendo o principal fator de risco. Ainda assim, casos diagnosticados em pessoas mais jovens, embora mais raros, indicam uma variedade na apresentação da doença.
O crescente ônus social e econômico da demência de Alzheimer aumenta a necessidade urgente de políticas de saúde pública que apoiem diagnósticos precoces, cuidados integrados e pesquisa contínua para tratamentos mais eficazes.
Essa compreensão epidemiológica é fundamental para orientar estratégias de prevenção e manejo da doença, garantindo melhores cuidados e qualidade de vida para pacientes e suas famílias.
Anatomia, histologia e fisiologia do cérebro
A anatomia, histologia e fisiologia do cérebro são fundamentais para entender a demência na doença de Alzheimer.
O cérebro humano é dividido em áreas que se conectam e desempenham funções complexas e relativamente específicas, como memória, linguagem e movimento. A camada externa, o córtex cerebral, é essencial para processos cognitivos complexos. As células nervosas, ou neurônios, transmitem sinais eletroquímicos através de conexões chamadas sinapses.
A comunicação entre neurônios é mediada por neurotransmissores, que desempenham um papel fundamental na transmissão de informações.
No contexto da doença de Alzheimer, mudanças patológicas afetam essas estruturas e processos. A acumulação de placas de proteína beta-amilóide e formação de emaranhados neurofibrilares interferem na função normal dos neurônios, levando à degeneração e morte celular.
Além do córtex cerebral, regiões como o hipocampo, crucial para a formação de novas memórias, são especialmente vulneráveis à doença de Alzheimer. O entendimento detalhado da anatomia, histologia e fisiologia do cérebro não apenas ajuda na compreensão dos sintomas da doença, mas também orienta a pesquisa de novas terapias e estratégias preventivas.
O conhecimento dessa base anatomopatológica e histofisiopatológica é essencial para a aplicação e o desenvolvimento de abordagens eficazes de diagnóstico e tratamento, visando mitigar o impacto devastador da doença de Alzheimer no funcionamento cerebral e na qualidade de vida dos pacientes.
Fatores de risco para a demência de Alzheimer
Os fatores de risco para a demência de Alzheimer abrangem uma variedade de influências genéticas e ambientais. A idade avançada é o principal fator, pois o risco de desenvolver a doença aumenta significativamente após os 65 anos. Histórico familiar também desempenha um papel importante, com estudos sugerindo que certas variantes genéticas podem aumentar a predisposição - a exemplo do gene ApoE ε4.
Estilo de vida desempenha um papel importante; por exemplo, uma dieta rica em antioxidantes e ácidos graxos ômega-3 pode ajudar a proteger contra a demência de Alzheimer. Além disso, atividade física regular e estimulação mental estão associadas a um menor risco.
Condições de saúde como hipertensão arterial, diabetes e obesidade também podem aumentar a vulnerabilidade à demência de Alzheimer, sugerindo uma ligação entre saúde cardiovascular e saúde cerebral.
Fatores ambientais como exposição a metais pesados e toxinas podem desempenhar um papel, com pesquisas em andamento.
Compreender esses fatores de risco é crucial para orientar estratégias de prevenção. A promoção de hábitos de vida saudáveis, a monitorização de condições de saúde e o manejo de fatores de risco podem ajudar a reduzir a incidência da demência de Alzheimer e melhorar a saúde cerebral a longo prazo.
Diagnóstico precoce
O diagnóstico precoce é importante na doença de Alzheimer porque permite o início imediato de tratamentos que podem retardar a progressão da doença e melhorar a qualidade de vida do paciente.
Testes neuropsicológicos, que avaliam habilidades cognitivas como memória, linguagem e raciocínio, são fundamentais para detectar mudanças sutis que podem indicar transtorno neurocognitivo associado à doença de Alzheimer em seus estágios iniciais.
Avaliações clínicas detalhadas, incluindo histórico médico completo e exames físicos, ajudam a descartar outras condições que podem causar sintomas semelhantes.
Novas técnicas de exames de imagem cerebral, como tomografia por emissão de pósitrons (PET) e ressonância magnética funcional (fMRI), também são utilizadas para detectar alterações no cérebro associadas à doença de Alzheimer antes mesmo do aparecimento dos sintomas evidentes.
Mais recentemente, novas opções de exames com maior sensibilidade e especificidade têm sido incorporadas para fornecer com maior precisão o diagnóstico da doença de Alzheimer:
- PET-CT cerebral com marcador beta-amilóide: Utiliza imagens cerebrais para identificar depósitos de proteína beta-amilóide no cérebro, que são indicativos da doença.
- Líquido Cefalorraquidiano (LCR): Coletado em geral através de punção lombar, o LCR é analisado para detectar níveis anormais de proteínas beta-amilóide e tau.
- Exame de Sangue (tau-fosforilada 217, razão beta-amilóide 42/40, APS2): Avalia biomarcadores específicos no sangue que ajudam a identificar a presença da doença de Alzheimer.
Patologia da doença de Alzheimer
A patologia da doença de Alzheimer envolve mudanças complexas no cérebro que afetam diretamente a função cognitiva. A característica principal é o acúmulo de placas de proteína beta-amilóide entre os neurônios. Essas placas interferem na comunicação neuronal e contribuem para a morte celular.
Além das placas, há também a formação de emaranhados neurofibrilares dentro dos neurônios. Esses emaranhados são compostos por uma proteína chamada tau - que perde sua estrutura normal - e se agrupam anormalmente, causando disfunção celular adicional.
Essas alterações patológicas resultam na perda progressiva de conexões neuronais e na degeneração dos próprios neurônios, especialmente em áreas do cérebro responsáveis pela memória e outras funções cognitivas. A neuroinflamação crônica também é observada no cérebro de pacientes com demência de Alzheimer, contribuindo para o ciclo de danos celulares e neurodegeneração.
A compreensão detalhada desses processos é crucial para o desenvolvimento de tratamentos eficazes que possam interferir na progressão da doença.
Pesquisas atuais estão focadas em terapias que possam reduzir a formação de placas beta-amilóide e emaranhados neurofibrilares, bem como abordagens que visam a proteção neuronal e a redução da inflamação cerebral.
Essa visão da neuropatologia da doença de Alzheimer ajuda a elucidar os mecanismos biológicos subjacentes à demência e a orientar esforços contínuos para encontrar estratégias terapêuticas que possam melhorar a qualidade de vida dos pacientes afetados.
Sintomas iniciais da demência de Alzheimer
Os sintomas iniciais da demência de Alzheimer podem ser sutis e facilmente atribuídos ao envelhecimento normal. A perda de memória recente é frequentemente uma das primeiras manifestações, como esquecer eventos recentes ou repetir perguntas. Dificuldades em planejar ou resolver problemas simples também podem surgir, além de prejuízo na capacidade de realizar tarefas habituais.
À medida que a doença progride, os sintomas tornam-se mais evidentes. Desorientação sobre tempo e lugar é comum, assim como dificuldades na compreensão de imagens visuais e relacionamento de objetos. Problemas de linguagem, como substituir termos incorretamente ou dificuldade em encontrar palavras certas, são outros indicativos.
Além dos sintomas cognitivos, mudanças de humor e personalidade podem ocorrer, incluindo apatia, irritabilidade e ansiedade. À medida que a demência avança, a capacidade de realizar atividades diárias pode ser significativamente comprometida.
É fundamental reconhecer os sinais precoces para buscar avaliação médica especializada. Um diagnóstico precoce permite o início de intervenções adequadas, como terapias farmacológicas e não farmacológicas, que podem ajudar a retardar a progressão dos sintomas e melhorar a qualidade de vida do paciente e de seus cuidadores.
A conscientização sobre os sintomas iniciais do transtorno neurocognitivo associado à doença de Alzheimer não só promove uma intervenção mais adequada, mas também destaca a importância de cuidados preventivos e da pesquisa contínua para entender melhor e tratar esta doença neurodegenerativa complexa.
Variações dos sintomas
Os sintomas iniciais da doença de Alzheimer podem variar amplamente de pessoa para pessoa, mas dois aspectos adicionais importantes a serem considerados são:
- Problemas de orientação: indivíduos podem começar a apresentar dificuldades em se orientar no tempo e no espaço. Isso pode se manifestar através de confusão sobre datas, estações do ano ou até mesmo onde estão localizados em momentos específicos.
- Prejuízo na tomada de decisões: outro sintoma precoce inclui dificuldades na tomada de decisões simples do dia a dia. Isso pode ser observado em situações como escolher roupas apropriadas para o clima ou decidir o que comer em uma refeição, evidenciando um declínio gradual na capacidade de realizar tarefas cotidianas de forma autônoma.
Reconhecer esses sinais adicionais pode ajudar na identificação precoce da doença de Alzheimer, facilitando intervenções que podem ajudar a retardar sua progressão e melhorar a qualidade de vida do paciente.
Progressão dos sintomas
A progressão dos sintomas da demência de Alzheimer varia de pessoa para pessoa, mas segue um padrão geral de deterioração gradual das funções cognitivas e comportamentais.
Inicialmente, sintomas leves como esquecimento ocasional e dificuldade em encontrar palavras podem surgir. Com o tempo, problemas de memória se agravam, afetando a capacidade de recordar eventos recentes e reconhecer pessoas próximas.
À medida que a doença progride para estágios mais avançados, outras habilidades cognitivas são afetadas. A linguagem pode deteriorar-se significativamente, levando a dificuldades na comunicação verbal. Além disso, habilidades motoras podem ser comprometidas, tornando difícil realizar tarefas simples do dia a dia.
Os sintomas comportamentais também se intensificam com o tempo. Pacientes podem apresentar mudanças de humor mais frequentes e imprevisíveis, como irritabilidade, agitação ou apatia.
Com a progressão da demência, é comum observar desorientação espacial e temporal mais pronunciada, além de necessidade crescente de assistência para atividades básicas como alimentação e higiene pessoal.
Entender a progressão gradual da demência de Alzheimer é fundamental para planejar cuidados e suporte adequados ao longo do tempo. Isso inclui ajustes na rotina diária, implementação de estratégias para manter a segurança do paciente e garantir que suas necessidades médicas e emocionais sejam atendidas de maneira compassiva e eficaz.
Estágios da progressão
A demência de Alzheimer progride tipicamente por três estágios principais: inicial, intermediário e avançado. Cada estágio apresenta sintomas específicos que afetam progressivamente a capacidade cognitiva, funcional e comportamental do paciente.
Variações da demência de Alzheimer
- Demência de Alzheimer esporádica: Este é o tipo mais comum de demência de Alzheimer, representando até 95% dos casos. Não há um padrão genético claro e é geralmente atribuído a uma combinação de fatores genéticos e ambientais.
A idade de início pode variar, mas geralmente ocorre após os 65 anos. Os sintomas desenvolvem-se gradualmente ao longo do tempo, afetando a memória, linguagem e outras funções cognitivas.
- Demência de Alzheimer familiar ou genética: Este tipo é menos comum, representando aproximadamente 5% dos casos. Em geral, é herdado de forma dominante e tende a se manifestar em idades mais jovens, por volta dos 30 aos 60 anos.
É causado por mutações genéticas específicas, como nos genes APP, PSEN1 e PSEN2. Pessoas com histórico familiar positivo têm um risco maior de desenvolver a doença em comparação com a população em geral.
- Demência de Alzheimer precoce: Também conhecido como demência de Alzheimer de início precoce ou de início antes dos 65 anos, este tipo afeta indivíduos mais jovens.
É menos comum e pode estar associado a variantes genéticas específicas que causam a doença em idades mais jovens do que a demência de Alzheimer tardia.
- Demência de Alzheimer tardia: É o tipo mais comum de demência de Alzheimer e geralmente afeta pessoas acima de 65 anos. A idade avançada é o principal fator de risco, e o desenvolvimento da doença está frequentemente relacionado a fatores como idade, histórico familiar e condições de saúde geral.
Compreender essas diferentes apresentações da demência de Alzheimer é crucial para diagnósticos precisos e para orientar estratégias de tratamento e cuidado personalizadas para cada paciente.
Diagnóstico de demência associada à doença de Alzheimer
O diagnóstico de transtorno neurocognitivo associado à doença de Alzheimer envolve uma avaliação abrangente baseada em sintomas observados e testes clínicos. Inicialmente, o médico realiza uma história clínica detalhada para entender os sintomas e seu impacto na vida diária do paciente. Testes cognitivos são aplicados para avaliar funções como memória, linguagem e habilidades de pensamento.
Exames de imagem, como tomografia computadorizada (TC) ou ressonância magnética (RM) de crânio, ajudam a excluir outras causas possíveis dos sintomas e a avaliar mudanças estruturais no cérebro. Biomarcadores no líquido cefalorraquidiano (LCR) , em exame de sangue ou imagens de PET-CT cerebral com marcador beta-amilóide podem ser utilizados para detecção de anormalidades associadas a placas de beta-amilóide e emaranhados neurofibrilares.
O diagnóstico diferencial é essencial para distinguir a doença de Alzheimer de outras condições que podem apresentar sintomas semelhantes, como depressão ou déficits vitamínicos. Uma equipe multidisciplinar, incluindo neurologistas, psiquiatras e neuropsicólogos, muitas vezes colabora para obter um diagnóstico preciso.
Um diagnóstico precoce é fundamental para iniciar intervenções que podem ajudar a retardar a progressão da doença e melhorar a qualidade de vida do paciente. Sendo assim, permite que pacientes e familiares planejem adequadamente o futuro e aproveitem ao máximo os recursos disponíveis.
Entender o processo diagnóstico da doença de Alzheimer é crucial para promover uma abordagem holística e integrativa no cuidado de pacientes, proporcionando suporte integral e personalizado ao longo da jornada da doença.
Tratamentos atuais para demência de Alzheimer
- Medicamentos para sintomas cognitivos: Inibidores da colinesterase, como donepezila, rivastigmina e galantamina, são comumente prescritos para adiar a progressão do prejuízo de funções cognitivas, como memória, linguagem e pensamento.
Eles funcionam aumentando os níveis de acetilcolina, um neurotransmissor crucial para a comunicação entre neurônios no cérebro afetado pela doença de Alzheimer.
- Medicamentos para sintomas comportamentais: Em casos nos quais sintomas como agitação, ansiedade, irritabilidade ou agressividade são proeminentes, podem ser utilizados antidepressivos, antipsicóticos ou estabilizadores de humor a critério médico.
Estes medicamentos ajudam a regular o humor e reduzir comportamentos disruptivos, proporcionando maior conforto ao paciente e melhorando a interação com cuidadores e familiares.
- Terapias não farmacológicas: Terapias comportamentais focam em manter as habilidades funcionais do paciente, promovendo independência em atividades diárias.
Fisioterapia pode ajudar a manter a mobilidade e prevenir complicações decorrentes da imobilidade. A musicoterapia, por sua vez, utiliza música para estimular áreas do cérebro relacionadas à memória e emoção, oferecendo conforto e bem-estar ao paciente.
- Abordagens baseadas em estilo de vida: Estimulação cognitiva através de jogos, quebra-cabeças e atividades que desafiam o cérebro podem ajudar a preservar funções cognitivas e retardar o declínio, mas ainda há pesquisas em andamento.
Atividades sociais regulares também são benéficas, pois promovem interações sociais que são importantes para o bem-estar emocional e mental.
- Cuidados de apoio: Além do tratamento direto ao paciente, é essencial fornecer apoio emocional aos cuidadores e familiares, que desempenham um papel fundamental no manejo diário da doença.
Programas de suporte, como grupos de apoio e educação sobre a demência de Alzheimer, ajudam a proporcionar um ambiente de cuidado mais informado e solidário.
Aprovação de anticorpos monoclonais pela FDA
A Food and Drug Administration (FDA) dos EUA recentemente concedeu aprovação à infusão dos anticorpos monoclonais lecanemabe e donanemabe para o tratamento da doença de Alzheimer. Este marco representa uma nova esperança para pacientes com comprometimento cognitivo leve ou estágio inicial de demência associados à doença de Alzheimer, os grupos foco dos ensaios clínicos.
O donanemabe é administrado como uma infusão intravenosa a cada quatro semanas. A dosagem recomendada é detalhada nas informações de prescrição, com um regime inicial de 700 mg a cada 4 semanas para as primeiras três doses, seguido por 1400 mg a cada 4 semanas.
A aprovação do donanemabe pela FDA é baseada em evidências de eficácia e segurança. Em um estudo duplo-cego, controlado por placebo (Estudo 1, NCT04437511), 1736 pacientes foram randomizados para receber donanemabe ou placebo por até 72 semanas.
Pacientes tratados com donanemabe demonstraram uma redução estatisticamente significativa no declínio clínico na Escala Integrada de Avaliação da Doença de Alzheimer (iADRS) em comparação com o placebo na Semana 76. Além disso, melhorias foram observadas na subescala cognitiva ADAS-Cog13 e na escala ADCS-iADL.
A segurança do donanemabe foi cuidadosamente avaliada. As informações do fabricante incluem um alerta para anormalidades de imagem relacionadas à amilóide (ARIA), que pode se apresentar como edema (inchaço) temporário no cérebro ou pequenos pontos de sangramento. Pacientes homozigotos do gene ApoE ε4 têm maior incidência de ARIA, sugerindo a necessidade de teste genético antes do início do tratamento.
Além disso, há risco de reações relacionadas à infusão, como sintomas semelhantes a gripe, náuseas, vômitos e alterações na pressão arterial. Reações de hipersensibilidade, incluindo anafilaxia e angioedema, também foram reportadas. Os efeitos colaterais mais comuns foram ARIA e dor de cabeça.
A FDA concedeu ao donanemabe designações de “Fast Track", "Priority Review" e "Breakthrough Therapy", refletindo a urgência e a promessa desse tratamento inovador na luta contra a doença de Alzheimer.
Administração e dosagem do donanemabe
O donanemabe é administrado por infusão intravenosa a cada quatro semanas, conforme detalhado nas informações do fabricante para garantir sua eficácia e segurança.
Os pacientes inicialmente recebem 700 mg nas primeiras três doses, seguidos por 1400 mg a cada quatro semanas. Este protocolo foi estabelecido com base em estudos clínicos rigorosos que avaliaram a resposta dos pacientes e sua tolerância ao medicamento.
É fundamental que os pacientes sigam rigorosamente o cronograma de dosagem recomendado e realizem as infusões sob supervisão médica para monitorar possíveis reações adversas e ajustar o tratamento conforme necessário.
Cuidados e manejo da doença
Cuidar de alguém com demência de Alzheimer requer uma abordagem holística e integrativa para garantir conforto e qualidade de vida. Isso inclui:
- Ambiente seguro: Modificar a casa pode incluir a instalação de corrimãos, barras de apoio no banheiro e iluminação adequada para reduzir o risco de quedas. Remover objetos desnecessários ou potencialmente confusos ajuda a manter o ambiente claro e organizado.
- Rotina estruturada: Estabelecer horários fixos para refeições, atividades e descanso ajuda a reduzir a ansiedade do paciente, proporcionando previsibilidade. Isso também pode incluir horários para medicação e atividades de lazer.
- Comunicação clara: Utilizar linguagem simples e direta, com frases curtas e pausas para permitir que o paciente processe informações. Evitar conversas complexas ou ambíguas ajuda a minimizar a frustração e a confusão.
- Estímulo cognitivo: Atividades como quebra-cabeças, jogos de memória e leitura podem ajudar a manter as habilidades cognitivas. Música e arte também são formas eficazes de estimular o cérebro e promover o bem-estar emocional.
- Nutrição adequada: Uma dieta balanceada, rica em frutas, vegetais, grãos integrais e proteínas magras, é fundamental. Incentivar a hidratação regular também é importante para a saúde geral e o funcionamento cognitivo.
- Suporte emocional: Tanto o paciente quanto os cuidadores podem se beneficiar de grupos de apoio, onde compartilham experiências e aprendem estratégias de enfrentamento. Educação sobre a doença ajuda a reduzir o estigma e a aumentar o entendimento sobre os desafios enfrentados.
- Monitoramento médico: Consultas regulares com profissionais de saúde permitem ajustes no tratamento conforme necessário. Avaliações periódicas ajudam a monitorar a progressão da doença e a adaptar o plano de cuidados de acordo.
Implementar essas práticas não apenas melhora a qualidade de vida do paciente com demência de Alzheimer, mas também apoia os cuidadores, proporcionando-lhes recursos e estratégias para enfrentar os desafios diários da doença.
Impacto social e econômico da demência de Alzheimer
O impacto da demência de Alzheimer na sociedade abrange diversas áreas cruciais:
O impacto social da doença é profundo, afetando não apenas os pacientes, mas também suas famílias. Cuidadores enfrentam desafios emocionais e físicos significativos, muitas vezes resultando em isolamento social e estresse emocional. A progressiva necessidade de cuidados intensos pode impactar negativamente a dinâmica familiar e a qualidade de vida de todos os envolvidos.
Em termos econômicos, a demência de Alzheimer gera custos substanciais. Os gastos diretos com cuidados médicos e os indiretos, como perda de produtividade no trabalho e necessidade de cuidadores, representam um fardo significativo para os sistemas de saúde e economias individuais. Esses custos tendem a aumentar à medida que a doença progride e mais cuidados especializados são necessários.
No âmbito educativo, a conscientização sobre a demência de Alzheimer é essencial. A falta de entendimento sobre a doença pode levar a estigmas sociais e dificultar o acesso a recursos adequados. A educação da população sobre os sintomas, cuidados e suporte disponível é crucial para melhorar a qualidade de vida dos pacientes e cuidadores.
Investimentos em pesquisa são fundamentais para avançar no entendimento da demência de Alzheimer e desenvolver tratamentos eficazes. Avanços científicos podem não apenas retardar a progressão da doença, mas também melhorar a qualidade de vida dos afetados e reduzir os custos associados ao seu manejo.
Em um nível político, políticas públicas voltadas para apoiar cuidadores, promover acesso a serviços de saúde e incentivar a pesquisa são indispensáveis. A implementação de políticas que reconheçam e respondam às necessidades das pessoas com demência de Alzheimer e suas famílias é importante para mitigar o impacto da doença na sociedade.
Apoio psicológico e emocional
O apoio psicológico e emocional desempenha um papel crucial na jornada de pacientes e familiares enfrentando a demência de Alzheimer:
É fundamental proporcionar um espaço seguro para que pacientes e familiares possam expressar emoções complexas como tristeza, frustração e ansiedade. Isso não apenas alivia o estresse emocional, mas também fortalece o bem-estar geral.
Os grupos de apoio desempenham um papel valioso, pois oferecem uma comunidade de indivíduos que compartilham experiências semelhantes. Esses grupos permitem que pessoas em situações semelhantes se conectem, compartilhem informações e ofereçam apoio mútuo, proporcionando um senso de companheirismo e compreensão.
A psicoterapia individual é uma ferramenta essencial que oferece não apenas um espaço seguro para explorar emoções, mas também estratégias práticas para lidar com o impacto emocional da doença. Os pacientes e cuidadores podem aprender técnicas para enfrentar desafios específicos e desenvolver habilidades de enfrentamento eficazes.
Educar familiares e cuidadores sobre as mudanças comportamentais e cognitivas associadas à demência de Alzheimer é crucial. Isso não só melhora a compreensão das dificuldades enfrentadas pelo paciente, mas também equipa os cuidadores com conhecimentos práticos para lidar com situações desafiadoras de maneira mais eficaz e empática.
Oferecer suporte contínuo aos cuidadores é essencial para ajudá-los a manter um equilíbrio saudável entre cuidar de si mesmos e cuidar do paciente. Isso pode incluir acesso a orientação sobre cuidados pessoais e monitoramento do bem-estar emocional dos cuidadores.
Esse suporte integral não apenas beneficia diretamente os pacientes e cuidadores, mas também contribui para uma qualidade de vida melhor e mais sustentável ao longo do curso da doença.
Pesquisa e avanços futuros
A pesquisa sobre doença de Alzheimer está na vanguarda da medicina atual, concentrando-se em diversas áreas essenciais que podem revolucionar o tratamento e manejo da doença.
Novos medicamentos estão sendo rigorosamente estudados para modificar a progressão da doença de Alzheimer, visando destruir proteínas anômalas e evitar a progressão de placas de beta-amilóide no cérebro afetado.
Avanços significativos em tecnologias de imagem, como PET e ressonância magnética funcional, estão possibilitando uma visualização mais detalhada e precisa das mudanças estruturais e funcionais no cérebro de pacientes com Alzheimer. Essas tecnologias são fundamentais para o suporte diagnóstico precoce e acompanhamento da progressão da doença.
Novas pesquisas têm demonstrado que testes diagnósticos mais sensíveis e específicos, tais como PET-CT cerebral com marcador beta-amilóide e biomarcadores no líquido cefalorraquidiano (LCR) ou no sangue, podem proporcionar maior precisão do diagnóstico da doença.
Estudos genéticos continuam a identificar variantes genéticas que aumentam o risco de desenvolvimento da doença de Alzheimer, permitindo estratégias de intervenção personalizadas e a identificação precoce de indivíduos em maior risco.
Além dos tratamentos farmacológicos em desenvolvimento, a pesquisa está explorando intervenções não farmacêuticas, como alimentação saudável, suplementos, exercícios físicos e programas de estimulação cognitiva. Essas abordagens têm mostrado potencial para retardar o declínio cognitivo e melhorar a qualidade de vida dos pacientes.
O financiamento global para pesquisa em doença de Alzheimer está em ascensão, incentivando colaborações multidisciplinares entre acadêmicos, indústria farmacêutica e organizações sem fins lucrativos. Essa cooperação é essencial para acelerar descobertas e traduzir pesquisas básicas em avanços clínicos significativos.
O futuro da pesquisa promete terapias mais eficazes e personalizadas, diagnósticos mais precisos e estratégias de prevenção mais robustas. Esses avanços não apenas têm o potencial de melhorar a qualidade de vida dos pacientes, mas também de aliviar o ônus sobre cuidadores e sistemas de saúde, oferecendo esperança significativa para aqueles afetados por esta doença devastadora.
Avanços no tratamento da demência na doença de Alzheimer com o Dr. Petrus Raulino
Compreender a demência na doença de Alzheimer não é apenas essencial para aqueles que enfrentam a doença, mas para toda a sociedade. Esta condição neurodegenerativa não só impacta profundamente os indivíduos afetados e seus familiares, mas também representa um desafio significativo para os sistemas de saúde em todo o mundo.
Ao longo deste blog, exploramos desde a definição e história da demência na doença de Alzheimer até os últimos avanços em pesquisa e tratamento.
É importante reconhecer a importância do diagnóstico precoce e do acompanhamento adequado, além de explorar as diversas opções terapêuticas disponíveis, tanto farmacológicas quanto não farmacológicas.
A pesquisa contínua e o desenvolvimento de novas terapias oferecem esperança para o futuro, promovendo uma melhor qualidade de vida para pacientes e suas famílias.
Para aqueles que buscam um tratamento eficaz e personalizado, marcar uma consulta com o Dr. Petrus Raulino pode ser o primeiro passo rumo a uma vida melhor.
Como médico especializado em psiquiatria, seu enfoque baseado em evidências científicas e centrado no paciente combina conhecimentos avançados de neurobiologia com um cuidado compassivo, priorizando não apenas o bem-estar emocional, mas também o monitoramento dos fatores biológicos orgânicos que influenciam no tratamento.
Continue se informando sobre condições de saúde relacionadas à psicofarmacologia no Blog do Dr. Petrus Raulino e esteja sempre atualizado sobre as melhores práticas para lidar com a demência na doença de Alzheimer e outras doenças neuropsiquiátricas.
Escetamina: o que é e para que serve?
O que é e para que serve escetamina? Milhões pelo mundo lutam contra a depressão resistente. Ela promete alívio rápido dos sintomas depressivos.
Esse avanço representa uma espécie de revolução no tratamento da depressão, mudando o panorama de recuperação. Mas como exatamente a escetamina destaca-se na luta contra a depressão resistente? Vamos nos debruçar por essa solução terapêutica, que promete transformar a vida dos que buscaram soluções em vão.
Pontos de atenção
Diante do combate à depressão resistente, a escetamina é destacada como uma nova opção terapêutica. Ela se diferencia pela capacidade de melhorar rapidamente os sintomas depressivos. Isso é um avanço importante para pacientes que não se beneficiaram de tratamentos convencionais. Mas é importante estar atento aos seguintes pontos:
- A infusão de cetamina para depressão é off label no Brasil, sendo on label (recomendação oficial) apenas a forma S (escetamina) intranasal no Brasil;
- O tratamento com cloridrato de escetamina é indicado para pacientes que não responderam a outros antidepressivos;
- A ação rápida da escetamina pode aliviar sintomas depressivos em menos de 24 horas após a administração;
- A aprovação pela Anvisa torna o uso de escetamina específico para o ambiente hospitalar ou clínica autorizada, sob monitoramento médico;
- A escetamina oferece um novo mecanismo de ação como modulador de glutamato, diferenciando-se de outros antidepressivos;
- O monitoramento médico é essencial devido aos potenciais efeitos colaterais da escetamina;
- O uso da escetamina requer cuidados especiais para prevenir abuso e dependência;
- A escetamina e sua função como tratamento inovador para depressão.
O que é a escetamina?
A escetamina trata adultos com depressão que não tiveram êxito com outros tratamentos. Por meio do uso intranasal, ela traz esperança para uma melhora eficaz e rápida dos sintomas graves.
Portanto, é um medicamento utilizado principalmente para o tratamento da depressão resistente ao tratamento (DRT) ou seja, transtorno depressivo maior (TDM) em adultos que não responderam adequadamente a outros antidepressivos, e para a rápida redução de sintomas depressivos em pacientes com comportamento ou ideação suicida aguda.
É um enantiômero do composto químico cetamina e atua como um antagonista do receptor NMDA, que está envolvido na modulação do humor e da percepção da dor. É administrada sob a forma de spray nasal e deve ser usada sob supervisão médica devido ao seu potencial para efeitos colaterais e abuso.
Indicações da escetamina e seu papel na depressão resistente ao tratamento
A escetamina deve ser recomendada por um psiquiatra bem qualificado e utilizada em ambientes controlados, como hospitais e clínicas especializadas. Em geral ela serve como tratamento coadjuvante aos antidepressivos orais, aumentando as chances de melhora ao proporcionar alívio mais rápido da doença.
Ação rápida da escetamina e seus efeitos nos sintomas depressivos
A escetamina, devido à sua ação como antagonista do receptor NMDA, pode proporcionar alívio rápido dos sintomas depressivos, muitas vezes dentro de horas ou dias, em comparação com as semanas que podem ser necessárias para que os antidepressivos tradicionais façam efeito.
Essa rapidez na ação torna a escetamina uma opção valiosa para pessoas com depressão grave e para aqueles que não tiveram sucesso com outros tratamentos.
Os efeitos podem incluir melhora do humor, aumento da energia e diminuição dos pensamentos suicidas. No entanto, os efeitos a longo prazo e a segurança do uso contínuo ainda estão sendo estudados. Além disso, seus benefícios tendem a ser transitórios e fugazes.
Mecanismos de ação: como a escetamina atua no organismo?
É vital entender como a escetamina opera no cérebro para compreender seu efeito contra a depressão. Esse medicamento se destaca por ser um modulador de glutamato, um mecanismo de ação que difere dos tratamentos convencionais. Isso marca um avanço importante no tratamento da saúde mental.
A escetamina atua no organismo como um antagonista seletivo do receptor N-metil-D-aspartato (NMDA), um subtipo de receptor de glutamato.
Ao bloquear esses receptores, a escetamina interfere na transmissão de sinais entre os neurônios mediados pelo glutamato, um neurotransmissor chave envolvido na regulação do humor e na cognição.
Este bloqueio pode resultar em um estímulo para maior atividade de outros neurotransmissores, como a serotonina, a noradrenalina e a dopamina, que podem contribuir para os efeitos antidepressivos e para a melhora do humor.
A escetamina também parece promover a neuroplasticidade, que é a capacidade do cérebro de se adaptar e reorganizar, o que pode ajudar a aliviar os sintomas depressivos.
Além disso, a escetamina parece ativar o sistema opióide, o que pode implicar em aumento do risco de dependência que deve ser muito bem avaliado pelo médico.
Receptores de glutamato e conexões neuronais
A escetamina interage diretamente com os receptores de glutamato, essenciais para a conexão entre células cerebrais. O glutamato, principal neurotransmissor excitatório do cérebro, desempenha um papel crucial na formação de memórias e na plasticidade cerebral.
Através da modulação desse neurotransmissor, a escetamina parece ajudar a reparar as conexões neurais danificadas pela depressão.
Diferenças entre a escetamina e outros antidepressivos
Os antidepressivos tradicionais atuam principalmente através da ação da serotonina e noradrenalina. A escetamina, por outro lado, foca no ajuste da atividade do glutamato, sua ação se baseia em um paradigma inovador e tem trazido resultados encorajadores, especialmente em casos onde outras abordagens falharam.
Além disso, a escetamina difere dos antidepressivos tradicionais em vários aspectos:
Mecanismo de ação: enquanto a maioria dos antidepressivos, como os inibidores seletivos da recaptação de serotonina (ISRS) e os inibidores de recaptação de serotonina e noradrelalina (IRSN), atuam aumentando a disponibilidade de neurotransmissores como serotonina e/ou noradrenalina, a escetamina atua bloqueando os receptores NMDA do glutamato.
Velocidade de ação: a escetamina pode proporcionar alívio dos sintomas depressivos de forma mais rápida, muitas vezes dentro de horas ou dias, enquanto os antidepressivos tradicionais podem levar semanas para mostrar benefícios.
Via de administração: a escetamina é administrada por via nasal, enquanto a maioria dos antidepressivos tradicionais é administrada por via oral.
Indicação: a escetamina é aprovada especificamente para o tratamento da depressão resistente ao tratamento ou para o transtorno depressivo maior com comportamento ou ideação suicida aguda - em combinação com um antidepressivo oral -, enquanto outros antidepressivos são usados como tratamento de primeira linha.
Efeitos colaterais: a escetamina pode ter um perfil de efeitos colaterais diferente, incluindo dissociação, aumento da pressão arterial, estado confusional, entre outros, que não são comumente associados aos antidepressivos tradicionais.
Potencial de abuso: devido às suas propriedades dissociativas e psicoativas, a escetamina tem um potencial de abuso e dependência, o que requer que seja administrada sob estrita supervisão médica.
Escetamina: uso aprovado e recomendações oficiais no Brasil
A saúde mental no Brasil recebeu um forte impulso com a aprovação da Anvisa para a escetamina intranasal. Esta decisão marca um avanço para terapias mais avançadas e focadas, especialmente para a depressão resistente a tratamentos convencionais.
Como tratamento on label, a escetamina oferece uma nova opção para aqueles que não se beneficiaram de métodos tradicionais. Mas seu uso seguro e efetivo é restrito a ambientes supervisionados, exigindo acompanhamento médico.
Administração exclusiva em hospitais ou clínicas autorizadas

Esses locais têm protocolos específicos para monitorar o paciente durante e após a administração do medicamento, garantindo a segurança e eficácia do tratamento. A supervisão médica no momento da administração permite o manejo imediato de quaisquer efeitos adversos. Mas a avaliação da resposta ao fármaco ao longo do tratamento é feita pelo médico psiquiatra que acompanha o paciente.
As redes de saúde têm um papel crucial na implementação correta do tratamento. Por isso, é vital seguir estritamente os protocolos para otimizar os benefícios terapêuticos e reduzir riscos.
Precauções e efeitos colaterais da escetamina
O uso da escetamina como terapia emergencial para depressão que não responde a tratamentos convencionais requer controle rigoroso. Isso assegura, simultaneamente, a eficácia e a segurança para quem a utiliza.
Dada a sua potência e impacto psicotrópico, a supervisão de um especialista é crucial em cada etapa do tratamento. Este acompanhamento busca reduzir riscos de reações adversas, entre elas:
- Gravidez e amamentação: a segurança da escetamina durante a gravidez e amamentação não está estabelecida, portanto não é recomendada.
- Dissociação: sensação de estar desconectado de si mesmo e da realidade.
- Sedação: sonolência ou sensação de calma excessiva.
- Tontura e náusea: sensações de vertigem ou enjoos.
- Aumento da pressão arterial: elevações transitórias na pressão arterial imediatamente após a administração.
- Efeitos cognitivos: dificuldade de atenção, julgamento e pensamento.
- Efeitos psiquiátricos: aumento da ansiedade, paranóia ou pânico.
Procure um profissional capacitado
Se você está enfrentando o Transtorno Depressivo Maior ou a depressão resistente ao tratamento e procura por uma abordagem especializada, não hesite em agendar uma consulta com o Dr. Petrus Raulino.
Com uma sólida formação em Medicina pela UNICAMP, residência médica em psiquiatria e psicoterapia também pela UNICAMP, e mais de 20 anos de experiência, o Dr. Raulino está preparado para oferecer o suporte e as opções de tratamento que você necessita.
Capsulotomia por Gamma Knife para Transtorno Obsessivo Compulsivo intratável
Por Dr. Petrus Raulino
Em um artigo publicado na revista Molecular Psychiatry, pesquisadores revisaram a evolução da psicocirurgia (neurocirurgia em psiquiatria) para Transtorno Obsessivo-compulsivo (TOC).
A psicocirurgia é reservada apenas para pacientes com TOC grave, incapacitante e refratário a várias tentativas de tratamento com medicação e psicoterapia. Os critérios de indicação são bastante rigorosos.
No passado, em uma época quando o tratamento farmacológico em psiquiatria era praticamente inexistente, a primeira fase da neurocirurgia em psiquiatria foi um período caracterizado principalmente por critérios de indicação pouco claros.
Havia um desconhecimento da neurobiologia dos quadros psiquiátricos. As técnicas cirúrgicas eram inadequadas, com lesões extensas e irreversíveis que produziam grandes efeitos adversos.
Atualmente, com o avanço da tecnologia e do conhecimento científico, o tratamento dos transtornos mentais graves por meio da neurocirurgia vem ganhando força na psiquiatria.
Uma modalidade neurocirúrgica atualmente utilizada é a capsulotomia por Gamma Knife. É parecida com radioterapia, onde feixes de raios gama são focalizados em regiões específicas do cérebro de forma não invasiva, induzindo uma “lesão” extremamente precisa.
Por meio desta técnica, há a interrupção de conexões entre áreas pré-frontais (dlPFC, OFC lateral e medial, vmPFC, ACC) e substância cinzenta subcortical (estriado ventral, núcleo dorsomedial do tálamo, hipotálamo, estria terminal, ponte e cinza periaquedutal) implicadas no TOC.
O objetivo é diminuir a gravidade dos sintomas, modulando as vias neurais do TOC, mas também aumentando a eficácia das terapias farmacológicas e psicológicas que funcionam de forma sinérgica com a capsulotomia por Gamma Knife.
As possíveis complicações incluem edema do lobo frontal ou a rara formação de cistos radionecróticos tardios, que são mais frequentes com antigas técnicas de capsulotomia. Esses eventos adversos se tornaram muito menos comuns com as novas doses de radiação e estratégias de direcionamento da capsulotomia por Gamma Knife.
Este procedimento deve ser realizado em centros especializados, capazes de oferecer cuidados multidisciplinares e de longo prazo, para o paciente e seus familiares.
Referências
Miguel, E. C., Lopes, A. C., McLaughlin, N. C., Norén, G., Gentil, A. F., Hamani, C., ... & Sheth, S. A. (2019). Evolution of gamma knife capsulotomy for intractable obsessive-compulsive disorder. Molecular psychiatry, 24(2), 218-240.
Rasmussen, S. A., Noren, G., Greenberg, B. D., Marsland, R., McLaughlin, N. C., Malloy, P. J., ... & Lindquist, C. (2018). Gamma ventral capsulotomy in intractable obsessive-compulsive disorder. Biological psychiatry, 84(5), 355-364.
Hirschtritt, M. E., Bloch, M. H., & Mathews, C. A. (2017). Obsessive-compulsive disorder: advances in diagnosis and treatment. Jama, 317(13), 1358-1367.
McGovern, R. A., & Sheth, S. A. (2017). Role of the dorsal anterior cingulate cortex in obsessive-compulsive disorder: converging evidence from cognitive neuroscience and psychiatric neurosurgery. Journal of Neurosurgery, 126(1), 132-147.
Rück, C., Larsson, J. K., Mataix-Cols, D., & Ljung, R. (2017). A register-based 13-year to 43-year follow-up of 70 patients with obsessive–compulsive disorder treated with capsulotomy. BMJ open, 7(5), e013133.
Brown, L. T., Mikell, C. B., Youngerman, B. E., Zhang, Y., McKhann, G. M., & Sheth, S. A. (2016). Dorsal anterior cingulotomy and anterior capsulotomy for severe, refractory obsessive-compulsive disorder: a systematic review of observational studies. Journal of neurosurgery, 124(1), 77-89.
Fineberg, N. A., Reghunandanan, S., Simpson, H. B., Phillips, K. A., Richter, M. A., Matthews, K., ... & Sookman, D. (2015). Obsessive–compulsive disorder (OCD): practical strategies for pharmacological and somatic treatment in adults. Psychiatry research, 227(1), 114-125.
Lopes, A. C., Greenberg, B. D., Canteras, M. M., Batistuzzo, M. C., Hoexter, M. Q., Gentil, A. F., ... & Miguel, E. C. (2014). Gamma ventral capsulotomy for obsessive-compulsive disorder: a randomized clinical trial. JAMA psychiatry, 71(9), 1066-1076.
Nuttin, B., Wu, H., Mayberg, H., Hariz, M., Gabriëls, L., Galert, T., ... & Schlaepfer, T. (2014). Consensus on guidelines for stereotactic neurosurgery for psychiatric disorders. Journal of Neurology, Neurosurgery & Psychiatry, 85(9), 1003-1008.
Garnaat, S. L., Greenberg, B. D., Sibrava, N. J., Goodman, W. K., Mancebo, M. C., Eisen, J. L., & Rasmussen, S. A. (2014). Who qualifies for deep brain stimulation for OCD? Data from a naturalistic clinical sample. The Journal of neuropsychiatry and clinical neurosciences, 26(1), 81-86.
Pauls, D. L., Abramovitch, A., Rauch, S. L., & Geller, D. A. (2014). Obsessive–compulsive disorder: an integrative genetic and neurobiological perspective. Nature Reviews Neuroscience, 15(6), 410-424.
Sheth, S. A., Neal, J., Tangherlini, F., Mian, M. K., Gentil, A., Cosgrove, G. R., ... & Dougherty, D. D. (2013). Limbic system surgery for treatment-refractory obsessive-compulsive disorder: a prospective long-term follow-up of 64 patients. Journal of neurosurgery, 118(3), 491-497.
Greenberg, B. D., Rauch, S. L., & Haber, S. N. (2010). Invasive circuitry-based neurotherapeutics: stereotactic ablation and deep brain stimulation for OCD. Neuropsychopharmacology, 35(1), 317-336.
Medicina de precisão para transtornos de humor
Por Dr. Petrus Raulino
O que são os transtornos de humor?
Os transtornos de humor afetam 1 em cada 4 pessoas ao longo da vida. Além de incapacitantes, são também co-mórbidos com outros transtornos psiquiátricos.
Devido à falta de testes objetivos para diagnóstico e ao estigma, os transtornos de humor costumam ser subdiagnosticados ou mal diagnosticados (por ex., diagnóstico de depressão em vez de transtorno bipolar).
Estudo sobre medicina de precisão
Para mudar o processo frequentemente longo de obter um diagnóstico e tratamento psiquiátrico, uma equipe da Indiana University of Medicine analisou como a medicina de precisão, através de biomarcadores sanguíneos de expressão gênica, poderia ajudar nesse cenário.
O estudo foi publicado na revista Molecular Psychiatry.
Os biomarcadores indicam a ocorrência de uma determinada função normal ou patológica de um organismo ou uma resposta a um agente farmacológico. Eles são usados, principalmente, para o diagnóstico ou para identificar riscos de ocorrência de uma doença em um paciente.
No estudo, foram encontrados 26 biomarcadores sanguíneos de expressão gênica principais, cujas análises foram levadas adiante. Os biomarcadores foram testados quanto à capacidade preditiva e utilidade clínica em coortes independentes adicionais.
Para o estudo, foram recrutados voluntários em três coortes independentes:
- “descoberta” de 26 biomarcadores (uma coorte longitudinal de indivíduos com mudanças diametralmente opostas no estado de humor em pelo menos duas visitas de teste consecutivas);
- validação dos 26 biomarcadores “descobertos” (uma coorte independente de indivíduos com depressão ou mania clinicamente grave);
- teste dos 26 biomarcadores “descobertos” (uma coorte independente para testar a capacidade dos biomarcadores de predizer estados de humor, depressão clínica ou mania, e para predizer futuras hospitalizações por depressão ou mania).
Resultados da pesquisa
Os resultados da pesquisa mostraram a utilidade dos biomarcadores para avaliar riscos que impactam a evolução clínica de pacientes com transtornos de humor.
Esse trabalho foi um grande passo em direção à compreensão, diagnóstico e tratamento dos transtornos de humor.
A expectativa é de que futuramente os biomarcadores preditores de risco possam ser úteis em abordagens preventivas, antes que se manifeste o transtorno totalmente desenvolvido ou ocorra recidiva.
Referências
Le-Niculescu, H., Roseberry, K., Gill, S. S., Levey, D. F., Phalen, P. L., Mullen, J., ... & Niculescu, A. B. (2021). Precision medicine for mood disorders: objective assessment, risk prediction, pharmacogenomics, and repurposed drugs. Molecular Psychiatry, 1-29.
Lenze, E. J., Rodebaugh, T. L., & Nicol, G. E. (2020). A framework for advancing precision medicine in clinical trials for mental disorders. JAMA psychiatry, 77(7), 663-664.
Alhajji, L., & Nemeroff, C. B. (2015). Personalized medicine and mood disorders. Psychiatric Clinics, 38(3), 395-403.
Modulação do canal iônico de potássio para tratamento da depressão?
Por Dr. Petrus Raulino
Um novo estudo desenvolvido pela Icahn School of Medicine Mount Sinai e publicado na revista American Journal of Psychiatry mostrou que a ezogabina, um fármaco que abre canais de potássio do tipo KCNQ2/3 no cérebro, pode estar associada à melhora de sintomas depressivos e anedonia.
O estudo é de fase 2, portanto ainda não serve como recomendação para mudança na conduta médica. Mas encoraja para a realização de novas pesquisas de fase 3 que poderiam fundamentar intervenções na prática clínica.
A ezogabina foi aprovada pela Food and Drug Administration dos EUA em 2011 como anticonvulsivante para o tratamento da epilepsia, mas não havia sido estudada anteriormente na depressão.
Esse estudo é o primeiro ensaio clínico randomizado controlado por placebo a mostrar que um fármaco que afeta esse tipo de canal iônico no cérebro pode melhorar os sintomas depressivos.
O estudo foi realizado com 45 pacientes adultos com diagnóstico de depressão que foram submetidos a um período de 5 semanas de tratamento com dosagem diária de ezogabina ou placebo.
Em comparação com os pacientes tratados com placebo, aqueles tratados com ezogabina mostraram uma redução significativa em vários sintomas importantes da depressão, incluindo a anedonia.
O alvo da ezogabina é o canal KCNQ2/3, que é membro de uma grande família de canais iônicos que atuam como controladores importantes da excitabilidade das células cerebrais e do funcionamento do sistema nervoso central.
Esses canais afetam a função das células cerebrais, controlando o fluxo da carga elétrica através da membrana celular na forma de íons de potássio (K+).
Os achados da pesquisa podem representar uma nova linha de pesquisas para o desenvolvimento de tratamentos novos e eficazes para a depressão.
Referências
Costi, S., Morris, L. S., Kirkwood, K. A., Hoch, M., Corniquel, M., Vo-Le, B., ... & Murrough, J. W. (2021). Impact of the KCNQ2/3 channel opener ezogabine on reward circuit activity and clinical symptoms in depression: results from a randomized controlled trial. American Journal of Psychiatry, appi-ajp.
Stafstrom, C. E., Grippon, S., & Kirkpatrick, P. (2011). Ezogabine (retigabine). Nature Reviews Drug Discovery, 10(10), 729-730.
Medicamentos epigenéticos para transtornos de ansiedade?
Por Dr. Petrus Raulino
Sobre os medicamentos epigenéticos
Medicamentos epigenéticos para transtornos de ansiedade ainda não são uma realidade na prática clínica, pois estão em fase de pesquisa experimental. Mas vale a pena acompanhar a evolução do conhecimento e saber sobre pesquisas em andamento.
Os transtornos de ansiedade são transtornos mentais comuns com uma prevalência anual global de 7,3%. A idade de início desses transtornos geralmente é por volta dos 20 anos, com as mulheres tendo duas vezes mais chances de receberem o diagnóstico.
Acredita-se que fatores psicológicos e biológicos contribuam para a patogênese dos transtornos de ansiedade.
Fatores psicológicos
Os fatores psicológicos envolvidos na patogênese envolvem eventos traumáticos e estressantes da vida, especialmente durante a infância. O estresse é conhecido por ativar muitos circuitos neuronais, como os do hipocampo, e o eixo hipotálamo-hipófise-adrenal (HPA).
Dentre os fatores biológicos, estão envolvidos mecanismos epigenéticos de expressão gênica, ou seja, traços complexos envolvendo múltiplos genes interagindo com fatores ambientais (não envolvendo mudanças na sequência do DNA, mas alterando a atividade de genes).
Os mecanismos epigenéticos envolvem mecanismos moleculares como metilação do DNA, hidroximetilação do DNA, modificações de histonas e regulação da expressão gênica mediada por RNA não codificador (ncRNA).
Fatores biológicos
Fatores ambientais podem provocar alterações nos mecanismos epigenéticos.
Há evidências de que os mecanismos epigenéticos apresentam-se desregulados em praticamente todos os tipos de transtornos psiquiátricos e que esses mecanismos desregulados contribuam para a patogênese.
A importância de novas pesquisas
Existem várias classes de medicamentos eficazes para o tratamento da ansiedade. No entanto, nem todas as pessoas se adaptam aos medicamentos disponíveis atualmente, devido a efeitos colaterais ou falta de resposta terapêutica satisfatória.
Por isso, a importância de novas pesquisas. Uma classe potencial de novos medicamentos para o tratamento da ansiedade são os medicamentos epigenéticos.
Ensaios pré-clínicos e clínicos farmacológicos – ainda experimentais – usando HDACi (inibidor da histona-desacetilase) para o tratamento estão mostrando resultados favoráveis, o que permite a continuidade das pesquisas com amostras maiores de pacientes.
Conclusão
O modo de ação do HDACi em transtornos de ansiedade ainda não está claro. Mais pesquisas são necessárias para elucidar o modo de ação do HDACi no alívio dos sinais e sintomas dos transtornos de ansiedade.
Há um longo caminho a seguir nessa linha de pesquisa, mas o conhecimento científico abre novas possibilidades que poderão transformar futuramente o rol de opções terapêuticas para os transtornos de ansiedade.
Referências
Peedicayil, J. (2020). The Potential Role of Epigenetic Drugs in the Treatment of Anxiety Disorders. Neuropsychiatric disease and treatment, 16, 597.
Schiele, M. A., & Domschke, K. (2018). Epigenetics at the crossroads between genes, environment and resilience in anxiety disorders. Genes, Brain and Behavior, 17(3), e12423.
Stein, D. J., Scott, K. M., de Jonge, P., & Kessler, R. C. (2017). Epidemiology of anxiety disorders: from surveys to nosology and back. Dialogues in clinical neuroscience, 19(2), 127.
Bartlett, A. A., Singh, R., & Hunter, R. G. (2017). Anxiety and epigenetics. Neuroepigenomics in Aging and Disease, 145-166.
Maron, E., & Nutt, D. (2015). Biological predictors of pharmacological therapy in anxiety disorders. Dialogues in clinical neuroscience, 17(3), 305.
Efeitos epigenéticos induzidos por estabilizadores de humor na Esquizofrenia e nos transtornos afetivos
Por Dr. Petrus Raulino
Uma pesquisa publicada na revista Frontiers in Pharmacology e realizada pelo Departamento de Psiquiatria e Psicologia da Mayo Clinic apresentou uma revisão sistemática de estudos que investigaram alterações epigenéticas induzidas por estabilizadores de humor não antipsicóticos (valproato, lítio, lamotrigina e carbamazepina).
A revisão buscou artigos científicos com modelos animais, linhagens celulares humanas e pessoas com Transtorno Bipolar, Esquizofrenia e Transtorno Depressivo Maior.
O epigenoma
Conhecer o epigenoma – a dinâmica que determina a expressão dos genes – permite saber melhor como os genes funcionam. O epigenoma responde a sinais ambientais “ligando” ou “desligando” a atividade de genes.
As alterações epigenéticas envolvem rearranjos de cromatina reversíveis que induzem padrões de expressão gênica mitoticamente hereditária, estável, de longo prazo e reversível sem alterar a sequência de DNA.
A metilação do DNA e as modificações nas histonas são as marcas epigenéticas mais estudadas em contextos fisiológicos e patológicos.
Em circunstâncias fisiológicas, os mecanismos epigenéticos controlam os processos neurobiológicos, mas a desregulação desses mecanismos pode se traduzir em um aumento do risco de desenvolvimento de doença.
Epimutações secundárias às interações gene-ambiente foram descritas como tendo um papel fundamental na fisiopatologia dos principais transtornos psiquiátricos, pois o material genético pode responder a modificações das condições ambientais.
Apesar da complexidade genética dos transtornos mentais, as evidências sugerem que o epigenoma pode ser modificado por estabilizadores de humor, potencialmente traduzindo-se em mudanças de longo prazo na evolução do transtorno.
Conclusão da pesquisa
A revisão concluiu que os dados científicos disponíveis confirmam efeitos do valproato e lítio no epigenoma de genes associados a transtornos psiquiátricos por diferentes mecanismos, sobretudo metilação de DNA e acetilação de histonas.
A revisão sugeriu que lamotrigina e carbamazepina podem ter um papel maior na ativação de mecanismos epigenéticos do que o número reduzido de estudos com esses fármacos parece sugerir.
Uma compreensão mais avançada das alterações epigenéticas induzidas por fármacos poderá facilitar no futuro intervenções personalizadas.
Referências
Gardea-Resendez, M., Kucuker, M. U., Blacker, C. J., Ho, A. M. C., Croarkin, P. E., Frye, M. A., & Veldic, M. (2020). Dissecting the epigenetic changes induced by non-antipsychotic mood stabilizers on schizophrenia and affective disorders: a systematic review. Frontiers in pharmacology, 11, 467.
Esteller, M. (2006). The necessity of a human epigenome project. Carcinogenesis, 27(6), 1121-1125.
Biomarcador sanguíneo pode ajudar a predizer Demência de Alzheimer anos antes que os sintomas apareçam?
Por Dr. Petrus Raulino
Um estudo publicado na revista Nature Translational Psychiatry evidenciou que idosos com proteína ácida fibrilar glial (GFAP) elevada no sangue apresentam maior acúmulo de proteína beta-amilóide no cérebro, um biomarcador associado a Demência de Alzheimer.
Mas afinal, o que é a GFAP?
A GFAP é uma proteína do citoesqueleto dos astrócitos que serve como um marcador da astrogliose – ativação e proliferação anormal de astrócitos decorrente de dano neuronal.
A proteína GFAP é encontrada no cérebro, mas pode ser medida em amostras de sangue quando o cérebro é danificado pela Demência de Alzheimer A no estágio inicial.
Atualmente, não há cura ou tratamento eficaz para reverter a Demência de Alzheimer, apesar de todos os esforços científicos. Por isso, há muitos estudos recentes buscando se concentrar em programas de prevenção e identificação de populações sob risco para Demência de Alzheimer.
Esses estudos têm reportado níveis elevados de GFAP no sangue em Demência de Alzheimer precoce e tardia. Esses níveis se correlacionam inversamente com a cognição e com a extensão da lesão da substância branca.
GFAP e os sintomas inicias da Dêmencia de Alzheimer
Mas o estudo publicado na Nature Translational Psychiatry investigou se os níveis elevados de GFAP no sangue precedem o início dos sintomas clínicos da Demência de Alzheimer em idosos cognitivamente normais sob maior risco de Demência de Alzheimer.
Resultados do estudo
A pesquisa mostrou que níveis plasmáticos de GFAP aumentados em idosos cognitivamente normais foram associados a maior acúmulo de proteína beta-amilóide no cérebro.
Portanto, o nível de GFAP plasmático aumentado pode servir como um biomarcador sanguíneo inicial para identificar indivíduos cognitivamente normais sob maior risco de Demência de Alzheimer.
Em nosso conhecimento, esse foi o primeiro estudo a demonstrar níveis plasmáticos aumentados de GFAP em idosos cognitivamente normais sob risco de Demência de Alzheimer. Essas observações sugerem que os danos se iniciam no estágio pré-sintomático da Demência de Alzheimer e está associado a acúmulo de beta-amilóide no cérebro.
Mais pesquisas são necessárias para avaliar se a dosagem de GFAP poderá fazer diferença para fundamentar estratégias de prevenção contra a Demência de Alzheimer. Por enquanto, estamos de olho em novas pesquisas.
Referências
Chatterjee, P., Pedrini, S., Stoops, E., Goozee, K., Villemagne, V. L., Asih, P. R., ... & Martins, R. N. (2021). Plasma glial fibrillary acidic protein is elevated in cognitively normal older adults at risk of Alzheimer’s disease. Translational psychiatry, 11(1), 1-10.
Elahi, F. M., Casaletto, K. B., La Joie, R., Walters, S. M., Harvey, D., Wolf, A., ... & Kramer, J. H. (2019). Plasma biomarkers of astrocytic and neuronal dysfunction in early-and late-onset Alzheimer's disease. Alzheimer's & Dementia.
Colangelo, A. M., Alberghina, L., & Papa, M. (2014). Astrogliosis as a therapeutic target for neurodegenerative diseases. Neuroscience letters, 565, 59-64.
Carter, S. F., Schöll, M., Almkvist, O., Wall, A., Engler, H., Långström, B., & Nordberg, A. (2012). Evidence for astrocytosis in prodromal Alzheimer disease provided by 11C-deuterium-L-deprenyl: a multitracer PET paradigm combining 11C-Pittsburgh compound B and 18F-FDG. Journal of Nuclear Medicine, 53(1), 37-46.